Contenidos
Porque se unen los atomos
Wikipedia
La tabla periódica enumera todos los elementos conocidos actualmente. También los enumera en un orden preciso, lo que nos permite obtener información adicional de un vistazo. Los elementos se enumeran desde arriba a la izquierda hasta abajo a la derecha en orden creciente de número atómico. El número atómico nos indica el número de protones de los átomos que componen el elemento. Aunque los átomos pueden perder electrones, no pierden protones, por lo que un átomo de oxígeno siempre tiene el mismo número de protones, ya sea en un compuesto, como elemento diatómico (O2) o con carga. Los números atómicos corresponden a los átomos individuales, no al elemento en su conjunto.
Las columnas de la tabla se denominan grupos. El grupo de un elemento nos da información sobre los electrones y la facilidad con la que un elemento dona o acepta electrones. La tabla también incluye la masa atómica de los elementos.
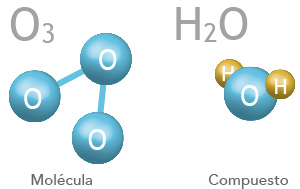
El agua es H2O y por su nombre químico correcto es dióxido de hidrógeno. (di = 2). Por tanto, hay dos átomos de hidrógeno y uno de agua (por lo que NO es un elemento). Mirando la tabla periódica encontramos que el hidrógeno tiene sólo un electrón (podemos saberlo por el número atómico – el número atómico del hidrógeno es 1, eso significa que tiene un protón, para ser neutro tiene que tener un electrón). En cambio, el oxígeno tiene 8 electrones. Por tanto, sólo puede estar unido a otro átomo.
Por qué se unen los átomos quizlet
Los átomos forman enlaces químicos para hacer más estables sus capas externas de electrones. El tipo de enlace químico maximiza la estabilidad de los átomos que lo forman. Un enlace iónico, en el que un átomo dona esencialmente un electrón a otro, se forma cuando un átomo se hace estable al perder sus electrones exteriores y el otro átomo se hace estable (normalmente al llenar su capa de valencia) al ganar los electrones. Los enlaces covalentes se forman cuando al compartir átomos se consigue la mayor estabilidad. Además de los enlaces químicos iónicos y covalentes, existen otros tipos de enlaces.
La primera capa de electrones sólo contiene dos electrones. Un átomo de hidrógeno (número atómico 1) tiene un protón y un electrón solitario, por lo que puede compartir fácilmente su electrón con la capa exterior de otro átomo. El átomo de helio (número atómico 2) tiene dos protones y dos electrones. Los dos electrones completan su capa exterior de electrones (la única capa de electrones que tiene), además el átomo es eléctricamente neutro de esta manera. Esto hace que el helio sea estable y que sea poco probable que forme un enlace químico.
Cómo se produce el enlace iónico
Este artículo necesita citas adicionales para su verificación. Por favor, ayude a mejorar este artículo añadiendo citas de fuentes fiables. El material sin fuente puede ser cuestionado y eliminado.Buscar fuentes: “Enlace químico” – noticias – periódicos – libros – scholar – JSTOR (marzo de 2015) (Aprende cómo y cuándo eliminar este mensaje de la plantilla)
Foto muestra la naturaleza de los enlaces químicos[1] en el grafito cristalino por densitometría de la nube de electrones ρ(x,y).[2] El átomo de carbono es esfera rosa de los dos electrones internos y cuatro electrones de valencia: dos enlaces π (color azul), que se produce lateralmente de la capa de grafito[3] y dos fuertes enlaces σ (verde) en forma de híbridos orbitales. [4] Se sabe que cada átomo de carbono del grafito tiene tres híbridos orbitales sp², pero la foto muestra el borde del cristal, por lo que falta el tercer átomo híbrido.
Un enlace químico es una atracción duradera entre átomos, iones o moléculas que permite la formación de compuestos químicos. El enlace puede ser el resultado de la fuerza electrostática de atracción entre iones de carga opuesta, como en los enlaces iónicos, o de la compartición de electrones, como en los enlaces covalentes. La fuerza de los enlaces químicos varía considerablemente; hay “enlaces fuertes” o “enlaces primarios”, como los covalentes, iónicos y metálicos, y “enlaces débiles” o “enlaces secundarios”, como las interacciones dipolo-dipolo, la fuerza de dispersión de London y el enlace de hidrógeno.
Enlace simple
Un enlace covalente es un enlace interatómico entre dos átomos. Los átomos enlazados tienen una energía total menor que la que se encuentra en átomos muy separados. El hecho de compartir un par de electrones crea una fuerza de atracción entre los centros atómicos (cargados positivamente) y los mismos dos electrones.
El químico estadounidense Gilbert Newton Lewis propuso por primera vez la idea de que un par de electrones podía compartirse entre dos átomos. Vio que esta compartición forjaría un vínculo entre ellos, y que dicho vínculo haría que ambos átomos tuvieran sus niveles de energía más externos llenos de electrones.
Los átomos de hidrógeno tienen un nivel de energía incompleto. Sólo un electrón orbita en el orbital 1s. Cuando dos átomos de hidrógeno se juntan, los centros atómicos cargados positivamente empiezan a atraer ambos electrones (el suyo y el del otro átomo). A cierta distancia, los orbitales se superponen y se fusionan en un único orbital molecular más grande en el que el par de electrones se distribuye sobre el par de centros atómicos.